Paulo Lopes Barsanelli
Nós todos tememos a tão comentada anestesia, alguns a temem mais que o próprio procedimento cirúrgico que a procede. Mas se olharmos para o passado, veremos que o que deveríamos realmente temer é a sua ausência ou os métodos anestésicos que antecederam os atuais, as hodiernamente injustiçadas seringas.
O desconhecimento de métodos analgésicos (que inibem a sensação de dor) pressionavam os médicos a agirem com extrema agilidade sobre os pacientes, que eram devidamente imobilizados, para que a extrema dor não perdurasse. Agrega-se nesta situação o fato de que as cirurgias se limitavam a pequenas operações superficiais e amputações de membros, um procedimento mais complicado era sinônimo de morte. A evolução do enfermo pós-operado era geralmente entregue à “vontade divina”. Os primeiros hospitais possuíam as famosas cúpulas que se encontravam isoladas no topo de seus prédios, onde os gritos provindos da cirurgia se limitavam.
O termo “anestesia” (do grego an, privado de + aísthesis, sensação) foi sugerido pelo médico e poeta norte-americano Oliver Wendel Holmes (1841-1935), porém já foi empregado pelo médico e cirurgião militar grego Dioscórides (40-90) no século I d.C. com o sentido de insensibilidade dolorosa. Atualmente o termo que define esta área na medicina é “anestesiologia” e foi criado em 1902.
Os primeiros métodos analgésicos consistiam:
- na compressão da carótida (artéria que leva sangue ao cérebro) do paciente, pelos assírios por volta de 1000 a.C., até que ele ficasse inconsciente;
- na mastigação de folhas de coca utilizada pelos Incas na América do Sul;
- na milenar acupuntura da China;
- na esponja saporífera, utilizada pelo médico grego Hipócrates (460 a.C. – 377 a.C.) no século IV a.C. (composta por ópio, sucos de meimendro, amoras amargas, eufórbia, mandrágora e hera, sementes de alface, bardana e cicuta que eram misturados num recipiente de cobre contendo uma esponja e então a mistura era submetida à fervura até evaporação total), que era posicionada sob as narinas dos pacientes que adormeciam e eram despertados depois com outra esponja embebida em vinagre;
- na concussão cerebral, utilizada na Europa medieval, a qual uma tigela de madeira era posicionada sobre a cabeça do paciente e em seguida era golpeada evitando forte impacto no crânio, mas levando a “vítima” à inconsciência;
- no congelamento por gelo ou neve das partes do corpo a serem operadas, utilizadas no século XVI;
- na hipnose por meio do “magnetismo animal” utilizado pelo médico austríaco Friedrich Mesmer (1733-1815) no século XVIII;
- na embriaguez por bebidas alcoólicas (principalmente vinho);
- e no emprego de magias e orações sobretudo durante a Idade Média.
O início de um grande passo para a mudança e melhoria na história das anestesias foi dado pelo químico inglês, Joseph Priestley (1733-1804), ao descobrir o óxido nitroso (N2O) em 1773, mas que não viu aí nenhuma utilização como anestésico. Priestley também isolou o gás oxigênio que chamou de ar desflogisticado baseado na teoria do flogístico (criada pelo cientista alemão Georg Ernst Stahl (1660-1734) que dizia que a combustão ocorria com certos materiais porque estes possuíam um “elemento” ou um princípio comum inflamável que era liberado no momento da queima).
O inglês Humprhy Davy (1778-1829), então aprendiz de farmácia, dá, em 1800, sua contribuição neste grande passo ao estudar os efeitos do óxido nitroso. Davy inalou o gás e experimentou de uma sensação de relaxamento e vontade involuntária de sorrir (este é o famoso “gás hilariante”, batizado por ele). Certa vez em que estava com dor de dente percebeu que ao inalar tal gás, a sensação de dor fora interrompida. Deduziu então que o óxido nitroso poderia ser indicado para inibir outras fontes de dores e sugeriu em uma de suas publicações intitulada de “Vapores Medicinais”, seu uso em cirurgias.
Michael Faraday (1791-1867), físico inglês, descreveu, em 1818, as propriedades analgésicas do éter etílico (ou éter sulfúrico: CH3CH2OCH2CH3) como sendo semelhantes às do óxido nitroso.
Em 1823, o médico e cirurgião inglês, Henry Hill Hickman (1800-1830) defendia que a via inalatória era caminho certo para obter a anestesia em procedimentos cirúrgicos. Hickman testava em cães a ação anestésica do gás carbônico e observava que os animais não apresentavam sinais de dores em pequenas operações às quais eram submetidos. A Royal Society e a Associação Médica de Londres não o autorizaram para que continuasse suas experiências em seres humanos. Hickman chegou perto de ser o grande descobridor da anestesia cirúrgica, talvez o fosse se tivesse feito uso de gases como o éter etílico ou mesmo o óxido nitroso.
No entanto, estes dois últimos gases ganharam notoriedade não na área da medicina, mas na do entretenimento, na qual eram utilizados em exibições circenses, festas e outros eventos públicos, onde os expectadores eram convidados a subirem ao palco e inalarem o gás para que experimentassem de seus efeitos que os induziam a rirem e dançarem para a alegria de todos os presentes.

Crawford W. Long à direita da foto, simula uma intervenção cirúrgica sob anestesia pelo éter.
Tais eventos (conhecidos então como festas do gás do riso) chegaram, em 1841, à pequena cidade de Jefferson (Atlanta, EUA) de 500 habitantes, onde o recém-formado em medicina pela Universidade da Pensilvânia (Filadélfia, EUA), Crawford Williamson Long, então com 26 anos, enxergou em toda essa diversão outra finalidade para a utilização desses gases. Utilizando do éter etílico ele descreveu: “Inalei inúmeras vezes o éter por causa de suas propriedades inebriantes e observei no meu corpo contusões e equimoses arroxeadas, provindas de quedas involuntárias durante as inalações da droga e notei que meus amigos debatiam-se tão fortemente que deveriam sentir alguma dor, mas que, inquiridos depois, responderam-me que nada haviam sentido”. Long deduziu então que a inalação do vapor do éter etílico poderia lhe trazer o mesmo resultado durante operações cirúrgicas.
No dia 30 de março de 1842 veio-lhe tal constatação quando, diante várias testemunhas, Long extirpou dois pequenos tumores da região superior do pescoço de seu paciente (um amigo, o estudante James M. Venable). Este procedimento ocorreu após Long usar do éter como anestésico geral colocando um lenço embebido deste sob o nariz de Venable até que ele gradualmente adormecesse e confirmando sua insensibilidade cutânea com uma agulha. Após recobrar a consciência, seu amigo não acreditou até que lhe fosse mostrado o cisto extraído.
Infelizmente, como outros pioneiros da ciência, Long sofreu interferência de religiosos radicais e também dos habitantes de Jefferson que acreditavam que seu novo método acabaria por matar algum de seus pacientes e então desistiu de aplicar em seus pacientes a promissora novidade. Entretanto, não deixou de crer em sua descoberta e administrou o éter como analgésico obstétrico à sua esposa no parto de seu segundo filho (em 1845) e nos posteriores.
Outra infelicidade que acometeu Long foi o fato de não ter publicado nada sobre sua descoberta, nada que provasse seu pioneirismo na anestesia geral.

Representação de uma das extrações dentárias realizada por Horace Wells.
Perto de se consolidar este grande passo da medicina que é a descoberta da anestesia, surge na história, Horace Wells (1815-1848), dentista na cidade de Hartford, que assim como Long, descobriu as propriedades do óxido nitroso através de uma apresentação pública. Então em 11 de dezembro de 1844, Wells, teve um de seus próprios dentes extraídos por um amigo após ter inalado o gás. Na ocasião não sentiu nenhuma dor.
Após realizar 10 outras indolores extrações dentárias em seus clientes, Wells contata um ex-aluno seu, William Thomas Green Morton (1819-1868), então estudante na Faculdade de Medicina de Harvard em Boston, e dirigiu-se até ele. E no Massachusetts General Hospital, diante de seu ex-aluno, professores e outros estudantes, Wells fracassa (talvez por administrar dose insuficiente do anestésico) ao tentar extrair sem dor, um dente de um estudante que se voluntariou. Após os gritos de dor do estudante, o dentista foi expulso como impostor.
De volta à sua cidade, continuou a utilizar de seu método, porém, após um paciente sofrer de parada respiratória e quase morrer, Wells decidiu abandonar a odontologia. Em 1847, publicou “A História da Descoberta da Aplicação do Óxido Nitroso, do Éter e de outros Gases em Cirurgia”, viciou-se em clorofórmio e em 1848 suicidou-se.
Em 1846, o primeiro grande passo na história da anestesia a caminho de como a conhecemos hoje foi concluído, justamente, pelo ex-aluno de Horace Wells, William Thomas Green Morton, e ironicamente no mesmo palco em que este último fracassara, no anfiteatro Bullfinch do Massachusetts General Hospital.
Morton, em seu segundo ano de medicina, insistiu nos estudos de Horace Wells e com a recomendação de seu ex-professor de química, o médico americano Charles Thomas Jackson (1805-1880), substituiu o óxido nitroso pelo éter. Realizou vários testes em cães e por último, em 30 de setembro de 1846, extraiu sem dor um dente de um comerciante da cidade de Boston.
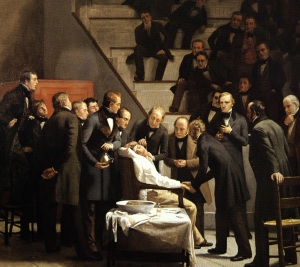
Quadro do pintor Roberto Hinckleu, de 1882, reproduzindo a cena da operação realizada com anestesia geral pelo éter em 16/10/1846.
Então no dia 16 de outubro de 1846, o cirurgião Dr. John Collins Warren (1778-1856) juntamente com o paciente Edward Gilbert Abott (um jovem impressor), portador de um tumor vascular no lado esquerdo do pescoço aguardavam a chegada de Morton que apareceu com um inalador de sua invenção que consistia num globo de vidro que continha o líquido volátil, anexado a uma cânula que direcionava os vapores à boca do paciente. Morton denominava seu anestésico de “Letheon” (do grego lethe, rio do esquecimento), que revelou pouco depois ser o já conhecido éter etílico. O paciente ficou inconsciente poucos minutos após sua aspiração e, seu tumor foi extirpado, a hemostasia (contenção de hemorragia) realizada e nenhum sinal de dor foi demonstrado. O fato de não necessitar de imobilização do paciente em semelhante procedimento cirúrgico foi surpreendente e após tal sucesso, Dr. Warren voltou-se à audiência estonteada e disse a seguinte frase “Cavalheiros, isto não é uma fraude.”.
Tal feito foi comunicado à Revista de Medicina e Cirurgia de Boston em 11 de novembro de 1846, e assim a notícia chegou à Inglaterra, a seguir à França e depois ao resto da Europa.
No Brasil, a primeira anestesia geral pelo éter foi realizada pelo Dr. Roberto Jorge Haddock Lobo (1817-1869), nascido em Portugal, em um estudante da Escola de Medicina do Rio de Janeiro, Francisco d’Assis Paes Leme, com intenção apenas experimental, em 25 de maio de 1847 no Hospital Militar do Rio de Janeiro.
Ao óxido nitroso e ao éter seguiu-se o clorofórmio, utilizado pela primeira vez em 1847, no trabalho de parto, pelo médico escocês James Young Simpson (1811-1870). Em 1930 foi introduzido o ciclopropano e em 1956, o halotano.
Apesar de que nessa época já eram conhecidos relatos de injeção de drogas e sangue por via venosa em animais, a agulha oca foi inventada somente em 1844 pelo médico irlandês Francis Rynd (1811-1861). Em 1853, o médico francês Charles Pravaz (1791-1853) desenvolveu a primeira seringa de metal e no mesmo ano, outro médico, o escocês Alexander Wood (1817-1884), realizou a primeira injeção intravenosa (de morfina) em um paciente.
A base das drogas anestésicas usadas hoje em dia partiu do hexobarbital (derivado do ácido barbitúrico) que foi introduzido em 1903 e principalmente do tiopental utilizado em 1934 que foi quem popularizou a indução anestésica intravenosa. Sucederam e sobrepuseram estas duas substâncias o propofol (1989), a procaína (1905), a dibucaína (1930, a tetracaína (1932), a lidocaína (1947), a cloroprocaína (1955), a mepivacaína (1957), a prilocaína (1960), a bupivacaína (1963), a ropivacaína e a levobupivacaína.
Referências:
http://super.abril.com.br/ciencia/eter-gas-hilariante-dois-dentistas-incrivel-historia-anestesia-444900.shtml
Clique para acessar o rezende-9788561673635-11.pdf
http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0034-70942006000300010
Clique para acessar o hahuc.pdf
Clique para acessar o v52n6a15.pdf
http://www.brasilescola.com/quimica/teoria-flogistico.htm
http://www.brasilescola.com/quimica/descoberta-oxigenio.htm



 origami, a arte de dobradura japonesa, transformaram pedaços de papel em belas e complexas estruturas tridimensionais. Aproveitando-se desta técnica, cientistas e engenheiros vêm tentando adaptá-la em materiais bidimensionais para transformá-los em estruturas “3D”, sejam elas em macro ou micro escala.
origami, a arte de dobradura japonesa, transformaram pedaços de papel em belas e complexas estruturas tridimensionais. Aproveitando-se desta técnica, cientistas e engenheiros vêm tentando adaptá-la em materiais bidimensionais para transformá-los em estruturas “3D”, sejam elas em macro ou micro escala.











Comentários